Amine - eine wichtige Stoffklasse in der amtlichen Lebensmittelüberwachung
- Vorkommen von biogenen Aminen in der Natur und deren Aufgaben
- Vorkommen von biogenen Aminen und heterozyklischen Aminen in Lebensmitteln
- Einfluss des Rohmaterials sowie Herstellungs- und Lagerungsbedingungen auf den biogenen Amingehalt im Lebensmittel
- Potentielle Gesundheitsschädigung durch Amine
- Amine in der amtlichen Überwachung von Lebensmitteln
- Rechtliche Vorgaben
- Weiterführende Informationen und Literatur
- Mehr zu diesem Thema
Als Amine werden organische Verbindungen bezeichnet, bei denen ein, zwei oder drei Alkyl- (z.B.
Methylgruppen) oder Arylgruppen (z.B.ein Phenylrest) das Stickstoffatom
umgeben.
Amine können nach dem strukturellen Aufbau der Moleküle in aliphatische, aromatische bzw. heterozyklische
Amine oder nach Anzahl der Aminogruppen in Mono-, Di- oder Polyamine eigeteilt werden. Wenn die biogenen Amine
aus einer Aminosäure gebildet werden, kann dies die Bezeichnung beeinflussen. Es gibt primäre aliphatische
Amine wie Methylamin, Tyramin oder Phenylethylamin, sekundäre Amine wie Dimethylamin, aromatische Monoamine
wie Benzylamin (Anilin) oder Tyramin, Diamine wie Putrescin und Polyamine wie Spermin oder Spermidin. In
Tabelle 1 findet man die Bezeichnung und Strukturformel ausgewählter Amine.
Tabelle 1: Beispiele für primäre, sekundäre oder tertiäre Amine
| Amin-Typ | Formel | Bezeichnung |
|---|---|---|
| Monamine (primäres aliphatisches Amin) | ||
| aliphatisches biogenes Amin | 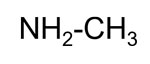 |
Methylamin |
| Aliphatisches Amin | 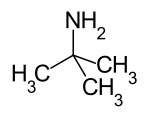 |
tert.-Butylamin (Trimethylaminomethan) |
| aromatisches Amin | 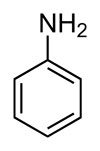 |
Benzylamin (Anilin) |
| aromatisches Amin | 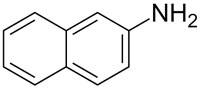 |
2-Naphtylamin |
|
Aromatisches biogenes Amin |
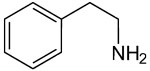 |
2-Phenylethylamin |
| Aromatisches biogenes Amin | 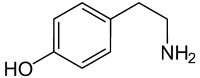 |
Tyramin |
| heterozyklisches biogenes Amin | 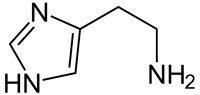 |
Histamin |
| Heterozyklisches Amin | 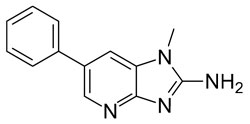 |
PhIP (2-Amino-1-methyl-6-phenylimidazo [4,5-b] pyridin ) |
| Biogenes Polyamin (2-(3-Indolyl)ethylamin) | 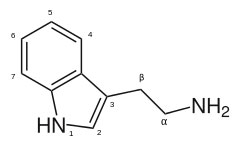 |
Tryptamin |
| Biogenes Amin, Indolamin | 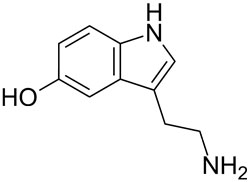 |
Serotonin |
| Diamine | ||
| Biogenes aliphatisches Diamin | 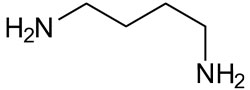 |
Putrescin |
| Sekundäres Amin | 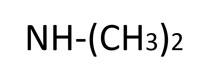 |
Dimethylamin |
| Polyamine | ||
| Biogenes Polyamin | 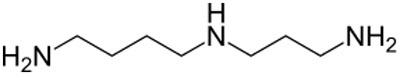 |
Spermidin |
| Tertiäre Amine | ||
| Aliphatisches Amin | 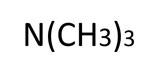 |
Trimetylamin |
| Triolamin | 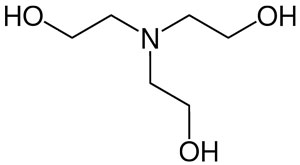 |
Triethanolamin (Trihydroxytriethylamin) |
Eine Reihe von Aminen spielen in der Natur eine große Rolle und kommen deshalb auch in Lebensmitteln vor. Vertreter der Stoffgruppe Amine werden industriell genutzt und können ggf. in Produkten wie Bedarfsgegenständen oder Kosmetika nachgewiesen werden (siehe Verwandte Themen).
Vorkommen von biogenen Aminen in der Natur und deren Aufgaben
Biogene Amine haben ein niedriges Molekulargewicht, gelten als organische Basen und sind häufig nicht flüchtig. In Einzelfällen können biogene Amine durch Einführung einer Amingruppe aus Aldehyden entstehen z.B. Methylamin aus Formaldehyd. In erster Linie jedoch werden sie im Stoffwechsel des Organismus durch enzymatische Decarboxylierung von Aminosäuren (d.h. Abspaltung eines Kohlendioxidmoleküls aus der Aminosäure) gebildet.
Unterschiedliche Bakterienstämme wie Milchsäure bildende Bakterien oder Escherichia sowie Pilze wie Hefen
oder Steinpilze besitzen derartige Enzyme. Auch im menschlichen oder tierischen Mikrobiom des Darmes gibt es
Bakterien, die über solche Enzyme verfügen. Beim Menschen entstehen so Histamin, Tyramin (Vorstufe des
Dopamins), Dopamin, Serotonin, Phenylethylamin und Tryptamin. Weitere Bildungsorte für biogene Amine im Körper
sind z.B. der Magen, Mutterkuchen und z.B.
bestimmte weiße Blutkörperchen. Beim Menschen sind die meisten biogenen Amine nur in minimalen Mengen,
manche sogar nur als Spurenamine in Gehirnzellen, Blut oder Urin feststellbar.
Auch in Algen, Pflanzen, vielen tierischen Lebewesen wie Fischen oder Wirbeltieren wurden viele
unterschiedliche biogene Amine nachgewiesen.
Bei Bakterien sichern die biogenen Amine das Überleben bei sauren Bedingungen, wirken Stressfaktoren wie
Erhöhung des Ionengehaltes in der bakteriellen Umgebung entgegen, tragen zur Energiegewinnung oder bei der
Abwehr von anderen Erregern z.B. durch Bildung von Virulenzfaktoren bei. So nimmt im sauren Milieu oder bei
Anwesenheit von Kochsalz die Bildung der Amine durch Aktivierung der entsprechenden bakteriellen Enzyme
zu.
In Pflanzen dienen biogene Amine wie Methylamin, Ethanolamin, Tyramin oder Phytoserotonin zur Abwehr von
Krankheitserregern und als Lockstoffe für Insekten. Sie beeinflussen Zellwachstum und Stoffwechselprozesse
oder sind Gewebshormone.
Bei Mensch und Tier haben biogene Amine viele wichtige Aufgaben: Histamin, Dopamin und Serotonin dienen im
zentralen oder peripheren Nervensystem als Botenstoff. Biogene Amine regulieren kognitive Fähigkeiten,
Stimmung, Schlaf, Magensäureabgabe, Darmbewegungen und stabilisieren Zellmembranen. Auch in der Teilung und
Differenzierung von Zellen z.B. der weißen Blutkörperchen, an der Regulation
der Körpertemperatur und des Blutdrucks, der Immunantwort bzw.
allergischen Reaktionen sind biogene Amine beteiligt. Zudem können bestimmte aromatische Amine die
Kontraktion der glatten Muskulatur im Darm, Lunge oder Gebärmutter bewirken.
Vorkommen von biogenen Aminen und heterozyklischen Aminen in Lebensmitteln
Biogene Amine wie Putrescin, Spermin und Spermidin kommen häufig in pflanzlichen und tierischen Lebensmitteln vor. Kohlgemüse, Bohnen, Kartoffeln oder Hirse enthalten beispielsweise diese drei Amine. Sauerkraut ist reich an Putrescin, Spermin, Spermidin und u.U. Histamin. Bananen und Tomaten enthalten viel Serotonin. Frisches Fleisch enthält wenig Putrescin, Spermin und Spermidin. Fermentierte Wurstwaren wie Salami haben dagegen deutlich höhere Gehalte. Histamin, Tyramin, Cadaverin und Putrescin wurden häufig in Meeresfrüchten und Fischen nachgewiesen. Auch andere biogene Amine wurden in Lebensmitteln bestimmt.
Im Lebensmittel werden die Gehalte an biogenen Aminen von vielen unterschiedlichen Faktoren wie der Beschaffenheit des Ausgangs-/Rohmaterials und den Bedingungen während der Herstellung beeinflusst. Die Messergebnisse zeigen deshalb eine große Spannbreite.
Heterozyklische Amine kommen natürlicherweise nicht vor und haben keine physiologische Funktion im Körper. Sie entstehen aus Aminosäuren, Proteinen und proteinhaltigen Lebensmitteln bei jeglicher Form des Erhitzens wie Braten von Fleisch und Fisch.
Einfluss des Rohmaterials sowie Herstellungs- und Lagerungsbedingungen auf den biogenen Amingehalt im Lebensmittel
Die natürliche oder ungewollte Besiedelung mit Bakterien oder Pilzen sowie die biogenen Amine abbauenden Enzyme des pflanzlichen oder tierischen Ausgangsmaterials sind wichtig für die Gehalte an biogenen Aminen im Lebensmittel. Bei Herstellung und Lagerung können Hygienemängel bei verderblichen Lebensmitteln wie Fleisch, Fisch- und Wurstwaren oder Speisepilzen für einen Anstieg biogener Amine wie Putrescin, Cadaverin, Tryptamin oder Histamin sorgen. Auch der bewusste Einsatz von Kulturen (Bakterien, Pilze) wie z.B. bei der Schimmelkäse- oder Salamiherstellung können die Menge der festgestellten biogenen Amine bedingen.
Die Pflanzenart und die Anbaubedingungen können ebenfalls die gemessenen Gehalte an biogenen Aminen in Lebensmitteln beeinflussen. Bei Rotwein wurden Unterschiede je nach Auswahl der Weintraubensorte und der Anbauregion festgestellt. Auch die Tierart ist maßgeblich. In einer Untersuchung an fermentierter Wurst war der Gesamtgehalt an biogenen Aminen bei Proben aus Truthahnwurst etwa 5,7-fach höher als bei Proben aus Pferdefleisch.
Die Auswahl des untersuchten Lebensmittelanteils (Rinde oder Inneres eines Käses, Muskelfleisch oder Innereien eines Tieres) oder der Entwicklungsstand eines pflanzlichen Gewebes kann ebenfalls die Höhe eines bestimmten Amin-Gehaltes mitbestimmen. Reife Früchte von Bananen oder Tomaten haben höhere Serotoningehalte als unreife. Beim Mais steigt der Spermin- und Spermidingehalt während der Keimung.
Die Beschaffenheit des pflanzlichen bzw.des tierischen Ausgangsmaterials sowie deren Verhalten während Produktion und Lagerung sind für die Gehalte an biogenen Aminen bedeutsam. Zu den Einflussfaktoren zählen Wasser-, Zucker- und Proteingehalt, die Zusammensetzung des Gewebes an unterschiedlichen Aminosäuren bzw. der Abbau von Proteinen in Aminosäuren während Produktion und Lagerung des Lebensmittels. Proteinreiche Lebensmittel haben beispielsweise in der Regel höhere Gehalte an biogenen Aminen als proteinarme. Thunfisch, Makrele und Sardine besitzen von Natur aus höhere Mengen der Aminosäure Histidin, so dass im Falle von Verderb auch höhere Histamingehalte auftreten können. Außerdem nehmen saure bzw. alkalische Produktionsbedingungen z.B. bei der Gärung von Kohl zu Sauerkraut, Temperatur, die Zugabe von Konservierungs- oder Lebensmittelzusatzstoffen wie Kochsalz, Vitamin C bzw. Zitronensäure u.U. Einfluss auf die Menge biogener Amine.
Potentielle Gesundheitsschädigung durch Amine
Nach der Europäischen Behörde für Lebensmittelsicherheit (EFSA) besteht bei Aufnahme von 25 bis 50 mg
Histamin über die Nahrung in der Regel bei funktionsfähigen Histamin-abbauenden Enzymen kein Gesundheitsrisiko
für Erwachsene. Steigen die Histaminmengen auf 75 und 300 mg, kann es zur Histamin-Intoleranz (auch
Histaminintoleranz-Syndrom) führen. Die Erkrankung wird als Pseudoallergie bezeichnet, bei der Schnupfen,
Kopfschmerzen, Gesichtsrötung, Magen-Darm-Beschwerden, Durchfälle, Müdigkeit, erniedrigter Blutdruck,
Kurzatmigkeit oder Herzrhythmusstörungen auftreten können. Nach EFSA soll die Erkrankungshäufigkeit für
Histamin-Unverträglichkeit etwa ein Prozent in der Gesamtbevölkerung betragen.
Diskutiert wird, dass die Erkrankung nicht nur nach Zufuhr von hohen Mengen Histamin mit der Nahrung auftreten
kann, sondern auch eine starke Bildung des Histamins im Körper zur Histamin-Unverträglichkeit beiträgt.
Hierfür könnten Veränderungen der Histamin-Rezeptoren oder einen Mangel an Histamin abbauenden Enzymen
verantwortlich sein. Nach Aussagen der Deutschen Gesellschaft für Allergologie und klinischen Immunologie
sowie anderer Fachgesellschaften gibt es bisher keine prospektiven, kontrollierten Studien, die einen Enzym
und/oder Enzymaktivitätsmangel als Ursache einer Unverträglichkeit gegenüber oral aufgenommenem Histamin
sicher belegen.
Die Einnahme von bestimmten Medikamenten oder Erkrankungen des Magen-Darm-Trakts können u.U. ebenfalls die Histamin-Unverträglichkeit fördern. Die Aufnahme oder
Bildung größerer Mengen an Tyramin, Phenylethylamin, Putrescin und Cadaverin verschlechtern ebenfalls das
Krankheitsbild bei Migräne-Patienten, erhöhen oder erniedrigen gegebenenfalls den Blutdruck. Auch
Herzrhythmusstörungen, Kribbeln in Armen und Beinen und Kiefersperre wurden nach Aufnahme größerer Mengen an
Putrescin oder Cadaverin beobachtet (EFSA
2011).
Heterozyklische Amine wie 2-Amino-1-methyl-6-phenylimidazo [4,5-b] pyridin (PhiP) bzw.
2-Amino-3,8-dimethylimidazo(4,5-f)quinoxalin (MeIQx) stehen im Verdacht beim Menschen Krebs zu erzeugen.
Andere Vertreter wie Dimethylamin können zu krebserzeugenden Nitrosaminen umgebaut werden. Informationen
findet man hierzu auf der Internetseite zu den Nitrosaminen.
Amine in der amtlichen Überwachung
Obwohl sehr viele Untersuchungsergebnisse zu verschiedenen Aminen in Lebensmitteln veröffentlicht sind,
konzentriert sich die amtliche Überwachung auf folgende Ansatzpunkte:
- Amine wie Putrescin, Cadaverin, Histamin werden als Indikator für mangelnde Hygiene, Verderb von Lebensmittel oder nicht sachgerechter Lagerung von Lebensmitteln untersucht. So wird auf den Internetseiten des LGL (siehe Mehr zu diesem Thema) oder in den Jahresberichten der Lebensmittelüberwachungsbehörden anderer Bundesländer über Untersuchungsergebnisse mit hohen Gehalten der genannten Amine in Lebensmittelproben berichtet.
- Im Rahmen der Gesundheitsvorsorge kontrolliert das LGL die Einhaltung des Grenzwertes für Histamin in Fischerzeugnissen. So untersucht das LGL beispielsweise Thunfisch aus offenen Konserven in der Gastronomie (siehe Jahresbericht 2011), Makrelen aus Biergärten oder auch asiatische Fischsoßen.
Rechtliche Vorgaben
In der Verordnung (EG) Nr. 2073/2005 über mikrobiologische Kriterien für Lebensmittel in Verbindung mit Verordnung (EU) 1019/2013 ist ein Grenzwert für Histamin in Fischerzeugnissen festgelegt.
Weiterführende Informationen und Literatur
EFSA (2011) Scientific Opinion on risk based control of
biogenic amine formation in fermented foods: EFSA Journal 9(10): 2393ff
Jahresbericht des Landesamts für
Verbraucherschutz des Landes Sachsen-Anhalt (2012): Untersuchungen zur Lebensmittelsicherheit.
Kalac P. (2006) Biologically active polyamines in beef, pork and meat products: A review. Meat Sciences
73:1-11
Lee et al. (2017) Changes in the Functional Compounds of Barley Produced from Different Cultivars an
Germination Periods. Cereal Chemistry 94(6): 978-983
Leiß O. (2014) Nahrungsmittelallergien, Intoleranz von Histamin und biogenen Aminen und
Mastzellüberaktivitätsssyndrom/Mastozytose. Verdauungskrankheiten 32(2): 89-103
Pfundstein B. et al. (1991) Mean Daily Intake of Primary and Secondary Amines from Food and Beverages in West
Germany in 1989-1990. Food Chem Toxicol 29(11): 733-39
Reese et al. (2017) Leitlinie zum Vorgehen
bei Verdacht auf Unverträglichkeit gegenüber oral aufgenommenem Histamin. Allergo J Int 26:72-79
Seigler DS. (1998) Simple Amines, Simple Aromatic and Pyrridine Alkaloids. In Plant Secondary Metabolism,
Springer Verlag, pp 513-53
Smith TA. (1981) Amines in Food. Food Chemistry 169-200
Mehr zu diesem Thema
Allgemeine Informationen zum Thema
- Toxische Reaktionsprodukte
Untersuchungsergebnisse
- Histamin in asiatischen Fischsoßen
- Tierische Lebensmittel aus Biergärten und Volksfesten
- Eiweißverderb von Steinpilzen - Untersuchungsergebnisse 2006-2008
- Qualität von geriebenem Käse in Fertigpackungen-Untersuchungsergebnisse 2015
- Mayonnaisen, emulgierten Soßen, kalte Fertigsoßen, kalte Fertigsoßen, Feinkostsalate

