Die Maul- und Klauenseuche (MKS)
Die MKS ist vor allem bei Rindern, Schafen, Ziegen und Schweinen eine hochansteckende Viruserkrankung der Klauentiere. Zudem können viele Zoo- und Wildtiere erkranken. Für den Menschen ist das Virus jedoch ungefährlich und durch den Verzehr von Lebensmittel sieht das BfR keine Gefahr für den Menschen.
Aktuelles Geschehen
Seit dem 14. April 2025 gilt Deutschland wieder als MKS-frei. Allerdings besteht aufgrund des dynamischen Seuchengeschehens innerhalb der EU ein erhöhtes Risiko der erneuten Einschleppung. Bayern ist auf einen möglichen MKS-Fall vorbereitet und steht im engen Austausch mit Bund und Ländern. Informationen zum aktuellen Ausbruchsgeschehen unter: Die Maul- und Klauenseuche (MKS) - Aktuelles.
Geschichte und Erreger
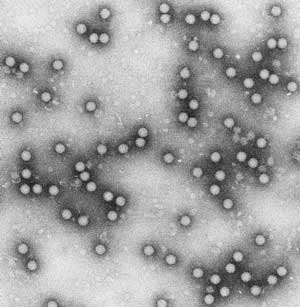
Abbildung 1: Elektronenmikroskopische Aufnahme des MKS-Virus.
Zur Verfügung gestellt von Dr. F. Weiland, BFAV, Tübingen
Die erste schriftliche Erwähnung der Krankheit datiert auf 1514, als Fracastorius in Italien ein entsprechendes Krankheitsbild beim Rind beschrieb. Im Rahmen der ersten Versuche zur Abgrenzung von Krankheitserregern, die kleiner als Bakterien sind, gelang es Loeffler und Frosch 1897/98 ein filtrierbares Agens als Erreger der MKS nachzuweisen. Später wurde das Genom des Erregers als Einzelstrang-RNA mit positiver Orientierung identifiziert. Es umfasst 8.500 Nukleinsäurebasen, die von vier Strukturproteinen umgeben sind, welche ein unbehülltes ikosaedrisches Kapsid bilden. Das Maul- und Klauenseuche-Virus (MKSV, engl. foot and mouth disease virus, FMDV) ist der Prototyp des Genus Aphthovirus in der Virusfamilie Picornaviridae (lat. pico = klein).
Vom MKSV sind sieben Serotypen bekannt, wobei innerhalb der Serotypen zahlreiche Untertypen (sog. Topotypen) vorkommen. Die sieben Serotypen werden historisch als A (für Allemagne), O (für departement „Oise“), C und Asia 1 sowie SAT 1-3 (für South African Territories) bezeichnet. Ausbrüche der MKS sind in allen nutztierhaltenden Regionen der Welt mit Ausnahme von Neuseeland vorgekommen. Momentan kommt die MKS außer in Australien und Nordamerika auf allen Kontinenten enzootisch vor. Das Virus kann alle Klauentiere inklusive der Nutztiere Rind, Schwein, Schaf und Ziege sowie über 70 verschiedene Wildtierspezies infizieren.
Klinik
Die MKS ist charakterisiert durch Fieber, Lahmheit und anfänglich vesikuläre (Bläschenbildung), später erosiv-ulzerierende Haut- und Schleimhautläsionen. Die bei der MKS auftretenden Bläschen werden auch „Aphthen“ genannt und sind hoch schmerzhaft. Die MKS ist gefürchtet als eine der Infektionskrankheiten mit höchst effizienter Ansteckungsrate. Problematisch ist ferner, dass kleine Wiederkäuer und verschiedene Wildtiere in der Regel nur milde klinische Symptome entwickeln und daher im Infektionsgeschehen häufig unerkannt bleiben. Einzelne infizierte Tiere können auch zu sogenannten Virusträgern (engl. „carrier“) werden und das Virus bis zu drei Jahren ausscheiden, ohne eine klinische Symptomatik zu entwickeln. Obwohl die MKS bei erwachsenen Tieren keine hohe Mortalität bewirkt, verursacht sie über längere Zeiträume eine allgemeine Leistungsminderung mit Gewichtsverlusten, gravierendem Rückgang der Milchleistung und der Reproduktionsleistung. Bei Jungtieren kann die Mortalität hoch sein, insbesondere in Folge von Herzmuskelschäden (sog. Tigerherz), die das Virus bei jungen Tieren verursachen kann. Die klinische Diagnose wird erschwert durch eine Reihe ähnlicher Krankheitsbilder, die dem „Vesikulärkomplex“ zugeordnet werden. Dazu zählen unter anderem die vesikuläre Stomatitis (VSV, Vesicolovirus), das Vesikulärexanthem (VE, Calicivirus) und die Vesikulärkrankheit (swine vesicular disease, SVD, porcines Enterovirus/Picornavirus) der Schweine. Bei Rind und Schaf gibt es eine Reihe von Krankheitsbildern mit Haut- und Schleimhautveränderungen, die der MKS ähnlich sind. Es ist deshalb bedeutsam, bei unklarer klinischer Symptomatik labordiagnostisch die MKS immer auszuschließen.
Diagnostik
Am LGL werden ausschließlich Ausschlussuntersuchungen oder differentialdiagnostische Abklärungsuntersuchungen durchgeführt. Liegt ein konkreter klinischer Verdacht auf MKS vor, ist die zuständige Untersuchungseinrichtung das Nationale Referenzlabor für MKS, Institut für Virusdiagnostik, Friedrich-Loeffler-Institut (FLI), Südufer 10, 17493 Greifswald – Insel Riems.
Als Untersuchungsmaterial eignen sich besonders das Epithel und die Flüssigkeit von frischen Läsionen (Aphthen) sowie Speichel- bzw. Maultupfer der Tiere. Auch Nasentupfer oder kombinierte Maul- und Nasentupfer können genommen werden. Bei der Probenahme ist darauf zu achten, dass trockene Tupfer verwendet werden und diese ausreichend mit der Schleimhaut in Kontakt kommen. Zudem sollte immer auch eine Serumprobe der betroffenen Tiere eingesendet werden. Nach Empfehlung der EuFMD (European Commission for the Control of Foot-and-Mouth Disease) sollten von allen klinisch auffälligen Tieren Proben genommen werden, aber nicht mehr als 20 Proben insgesamt. Für den direkten Virusnachweis ist die molekulare Diagnostik in Form der Polymerase-Kettenreaktion (Realtime RT-PCR) die Methode der Wahl, für den Antikörpernachweis stehen kommerzielle ELISA-Tests zur Verfügung.
Epidemiologie und Bekämpfung
Seit Beginn des 20. Jahrhunderts ist die MKS eine ständige Bedrohung. Sie wird unverändert als die handelspolitisch bedeutendste Infektionskrankheit wahrgenommen und von der World Organisation for Animal Health (WOAH) in der Liste der international wichtigsten Tierseuchen geführt. In Deutschland unterliegt die MKS der Anzeigepflicht.
In Europa kamen MKS-Ausbrüche im späten 19. und frühen 20. Jahrhundert zwar nur sporadisch vor, hatten aber immer verheerende Konsequenzen. Anfang der 50er Jahre registrierten einige westeuropäische Länder (unter anderem auch Deutschland) 10.000 bis 100.000 Ausbrüche pro Jahr. Erste inaktivierte Impfstoffe wurden schon um 1930 in Deutschland hergestellt. Aber erst durch die Impfstoffherstellung über infiziertes bovines Zungenepithel (Frenkel Vakzine) und später durch Virusvermehrung in Zellkulturen (BHK-21 Zellen) und den Einsatz von Adjuvantien konnte eine kommerzielle Impfstoffproduktion verwirklicht werden. Als Ergebnis konsequenter Impfprophylaxe konnten beachtenswerte Erfolge im Kampf gegen die MKS erzielt und die Seuche immer weiter zurückgedrängt werden. Schließlich wurden nur noch sehr limitierte, kleinere Ausbrüche in Europa (Balkan, Italien, Russland) festgestellt, so dass die EU seit 1989 eine Nicht-Impfpolitik propagiert. In Afrika und in vielen Ländern des Nahen und Mittleren Ostens sowie Asiens kommt die MKS endemisch vor.
MKS-Geschehen in Europa in den letzten Jahren
Nach Ausdehnung der MKS-freien Gebiete (z. B. auch in großen Teilen Südamerikas) verblieben weltweit nur noch wenige Endemiegebiete (Naher und Mittlerer Osten, Afrika und Teile Asiens).
Der letzte große Ausbruch in jüngerer Zeit in Europa ereignete sich ausgehend vom Vereinigten Königreich (UK) im Jahr 2001. Als ursächliches Virus wurde der Serotyp O PanAsia (O/UK/2001) identifiziert. Seit einem kleinen Ausbruch 1981 auf der Insel Wright war dies die erste Rückkehr des Virus auf die größte europäische Insel. Die Erkrankung ging vom Schwein aus. Erste Verdachtsfälle wurden in einem Schlachthof in Essex registriert. Die Seuche verbreitete sich rasant im Vereinigten Königreich. Der kritische Faktor dieses Ausbruchs waren infizierte Schafe, die klinisch unerkannt gehandelt und auf Märkten ausgestellt wurden.
Bei dem Ausbruch in UK wurden vier Millionen Tiere, hauptsächlich Schafe, getötet. Die Kosten wurden auf ca. 13 Milliarden U.S. Dollar berechnet. Der Ausbruch im Vereinigten Königreich weitete sich auf Irland, Frankreich und Holland aus. Im Gebiet der wenigen betroffenen Betriebe in Irland und Frankreich konnte die Seuche durch Tötungsaktionen kontrolliert werden. In Holland entschied man sich für eine so genannte Suppressions- oder Interventionsimpfung. Es wurden ungefähr 200.000 Tiere geimpft unter der Auflage, dass die geimpften Tiere ausschließlich zur Schlachtung bestimmt wurden. Im UK wurde der MKS-freie Status ohne Impfung am 22. Januar 2002 wiedererlangt. Nach retrospektiven Analysen kam die Royal Society zu dem Schluss, dass Notfallimpfungen (Suppressions-/Interventionsimpfungen) unbedingt als Teil der Kontrollmaßnahmen im Falle eines größeren MKS-Ausbruchs vorgenommen werden sollen. Um einen Ausbruch bzw. Infektionen schnell und sicher zu erkennen, kommen moderne diagnostische Methoden wie der molekulare Virusgenomnachweis zur Anwendung.
Impfstoffe und Impfungen
Nach EU-Recht VO (EU) Nr. 2016/429 ist die Impfung bei bestimmten, nicht in der Union vorkommenden Tierseuchen, wie der Maul- und Klauenseuche, verboten. Zur Tilgung und Bekämpfung kann im Seuchenfall eine Ausnahme vom allgemeinen Impfverbot zugelassen werden. Für diese Fälle wird seit Einstellung der MKS-Impfung innerhalb der EU in zentralen MKS-Impfstoffbanken Antigen verschiedener Serotypen (meist A/O und C) vorgehalten. So können kurzfristig spezifische Impfstoffe hergestellt werden. Bei den heute für Notfallimpfungen kommerziell verfügbaren Vakzinen handelt es sich um inaktivierte Ganzviruspräparationen, die als Konzentrate in der Gasphase von Flüssigstickstoff gelagert werden und kurz vor dem Feldeinsatz mit Adjuvans versetzt werden.

