Nahrungsergänzungsmittel (NEM) – Untersuchungsergebnisse 2013
Nahrungsergänzungsmittel sind im Unterschied zu klassischen Lebensmitteln oder Lebensmitteln für einen besonderen Ernährungszweck dazu bestimmt, die allgemeine Ernährung durch Nährstoffe wie Vitamine, Mineralstoffe, Spurenelemente sowie sonstige Stoffe als wertgebende Bestandteile zu ergänzen. Obwohl NEM in einer arzneimittelähnlichen Form angeboten werden, sind sie von diesen klar abzugrenzen. Dies gilt insbesondere hinsichtlich der Wirkung von Inhaltsstoffen und der Bewerbung.
Beanstandungen von NEM
Der Vertrieb von NEM erfolgt zunehmend über das Internet, was für den Verbraucher ein Risiko darstellen kann, insbesondere bei Produkten aus Drittländern. Die Überwachung von NEM erfolgt über die Beurteilung von dem LGL vorgelegten Produkten sowie von Produktetiketten, die dem LGL im Rahmen der Anzeigepflicht nach Nahrungsergänzungsmittelverordnung (NemV) zur Verfügung stehen. NEM mit Wirkversprechen unter anderem zu gewichtsverringernden Eigenschaften, Ersatz für Potenzmittel oder leistungssteigernden Präparaten für Sportler stufte das LGL wegen pharmakologisch wirksamer Inhaltsstoffe als unzulässige Arzneimittel ein; sie waren somit nicht verkehrsfähig. Dies gilt auch für NEM mit ausschließlich medizinischer Zweckbestimmung wie Produkte aus der traditionellen chinesischen Medizin (TCM) als „wirksame Heilmittel“ oder ungenießbare Heilpilze. Des Weiteren beanstandete das LGL den Gehalt an freiem Chlor in einem Produkt aus den USA, den unzulässigen Zusatz von Vitamin D-Hefe, die unzulässige Mineralstoffverbindung Vanadylsulfat, Klinoptilolith als neuartige Lebensmittelzutat sowie zahlreiche Stoffe, die ohne Vorlage entsprechender Nachweise als neuartig einzustufen waren. In einem Enzympräparat wies das LGL nicht zulässiges Chloramphenicol nach. Ein Klinoptilolithprodukt enthielt einen Bleigehalt weit über der zulässigen Höchstmenge sowie einen gesundheitlich bedenklichen Gehalt an Arsen. Beide Präparate wurden wegen der gesundheitsschädlichen Wirkung aus dem Verkehr gezogen. NEM und Werbeaussagen Eine Werbeaussage, die die Beseitigung, die Linderung oder die Verhütung von Krankheiten verspricht oder angsteinflößende Aussagen verwendet, ist für Lebensmittel nicht zulässig. Das LGL beanstandete Aussagen wie beispielsweise „zur Prävention …“, „bei bestehenden Herz-Kreislauf-Erkrankungen … “, „zum Schutz gegen Osteoporose“ oder auch Werbeaussagen, die an die Ängste der Verbraucher vor Mangelversorgung mit den möglichen Spätfolgen appellieren, wie „eine Unterversorgung hat weitreichende Folgen, die sich unter anderem in Erkrankungen wie … äußern können“. Neben irreführenden Werbeaussagen und Gehaltsangaben beanstandete das LGL nicht zulässige Hinweise darauf, dass die Zufuhr angemessener Nährstoffmengen durch eine ausgewogene gesunde Ernährung nicht möglich sei. Gesundheitsbezogene Bewerbung bei NEM Gesundheitsbezogene Angaben oder „Health Claims“ im Sinne der Verordnung (EG) Nr. 1924/2006 auf der Packung, dem Beipackzettel, auf Flyern oder im Internet müssen zulässig sein, um verwendet werden zu dürfen. Im Vergleich zu 2012 und den Vorjahren sind mittlerweile viele der am LGL untersuchten Produkte diesbezüglich vorschriftsmäßig gekennzeichnet. Zulässig sind zum Beispiel Angaben wie „Vitamin C trägt zu einer normalen Funktion des Immunsystems bei“ oder „Calcium wird für die Erhaltung normaler Knochen benötigt“. Auffällig und zu beanstanden ist jedoch nach wie vor, dass oft das Produkt als solches mit Vorteilen angepriesen wird, für die es keine Zulassung gibt bzw. für die keine Zulassung beantragt wurde. Anzeigen von NEM Die risikoorientierte Überprüfung von ca. 1.000 Etiketten von angezeigten Nahrungsergänzungsmitteln als Beurteilungsgrundlage führte 2013 bei ca. 5 % der Anzeigen zu einer Einstufung als Arzneimittel bzw. zu einer Beanstandung aufgrund unzulässiger Zusammensetzung der Produkte.
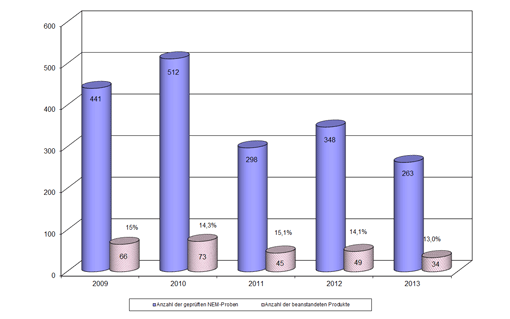
Nahrungsergänzungsmittel (NEM) sind sehr vielfältig zusammengesetzt, sodass Beurteilungen meist aufwendige Einzelfallentscheidungen zugrunde liegen. Hinzu kommt, dass bisher etwa für Vitamine und Mineralstoffe Regelungen zu Mindest- und Höchstgrenzen fehlen. Zudem gibt es für die Beurteilung von pflanzlichen und tierischen Inhaltsstoffen in NEM noch keine einheitlichen verbindlichen Vorgaben. Im Bereich der NEM untersucht und beurteilt das LGL sowohl gegenständliche Proben als auch die Etiketten der nach Nahrungsergänzungsmittelverordnung angezeigten Produkte. Pro Jahr werden dem LGL etwa 260 bis 500 gegenständliche Proben NEM zur Untersuchung und Beurteilung vorgelegt. Im Jahr 2013 beanstandete das LGL 13 % (siehe Abbildung).
Hauptsächliche Beanstandungsgründe sind:
- Einstufung von NEM als Arzneimittel Verwendung nicht zugelassener Stoffe
- Einstufung von Zutaten als neuartige Lebensmittel
- Mängel bei der Verwendung gesundheitsbezogener Angaben (Health Claims) in der Produktbewerbung
- irreführende und krankheitsbezogene Werbung auf der erpackung, in der Packungsbeilage oder im Internet
- Kennzeichnungsmängel insbesondere im Hinblick auf die Vorgaben nach Nahrungsergänzungsmittelverordnung.
NEM bedürfen nach wie vor einer intensiven Kontrolle, um ein akzeptables Verbraucherschutzniveau zu gewährleisten. Besonders gilt dies für Produkte, die über das Internet angeboten werden. Es ist zu erwarten, dass sich die Beanstandungsquote weiterhin auf gleichbleibend hohem Niveau bewegt.