- Startseite >>
- Produkte >>
- Kosmetika >>
- Kosmetische Mittel
Kosmetische Mittel und Stoffe zu deren Herstellung - Untersuchungsergebnisse 2005
- Nitrosamine in Kosmetika – nach wie vor ein Problem?
- Dauerbrenner: Sonnenschutz
- Fluoridierte Mundwässer - sinnvolle Ergänzung zur Kariesprophylaxe?
- Die mikrobiologische Beschaffenheit kosmetischer Mittel
- Irreführung – Versprechen und Wirkung von Kosmetika?
- BSE-Zertifikate für den Export von Kosmetika
- Überprüfung der Produktunterlagen
- Allergene Duftstoffe in Kosmetika sind jetzt deklarationspflichtig
- Mehr zu diesem Thema
Nitrosamine in Kosmetika – nach wie vor ein Problem?
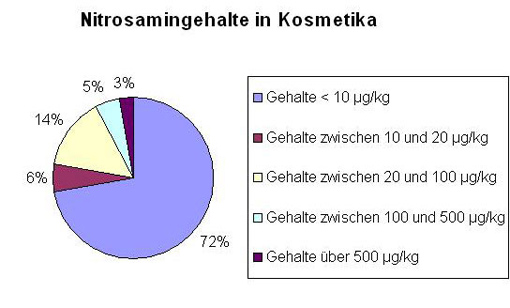
Die Überprüfung auf Nitrosamine in Kosmetika wurde auch 2005 fortgesetzt, wenn sich aufgrund der verwendeten Bestandteile oder sonstiger Umstände ein Verdacht auf das Vorhandensein dieser Stoffe ergab. Mögliche Quellen für die Nitrosaminbelastung sind die Verwendung verunreinigter Rohstoffe, die Bildung durch Reaktion verschiedener Kosmetikbestandteile oder das Verpackungsmaterial. Von insgesamt 140 untersuchten Produkten wiesen 101 Erzeugnisse Gehalte unter der Nachweisgrenze von 10 µg/kgNDELA auf; das entspricht 72 % der Proben. Bei 28 % der Proben dagegen lagen die ermittelten Werte über der Nachweisgrenze von 10 µg/kg. Die Verteilung der Gehalte auf verschiedene Gehaltsbereiche ist im Diagramm „Nitrosamingehalte in Kosmetika“ dargestellt. Eine hohe Beanstandungsquote von jeweils 33 % ergab sich bei den beiden Produktgruppen Spezialhandreinigungsmittel und Wimperntusche. Vier Produkte, die in der Tabelle „Nitrosamine in Kosmetika“ aufgeführt sind, fielen wegen besonders hoher Nitrosamingehalte auf.
| Probenart | Herkunft | NDELA (µg/kg) |
|---|---|---|
| Aloe Hautpflegegel | Südafrika | 4.128 |
| Liquid Eyeliner | EU | 1.002 |
| Rosenseife | unbekannt | 801 |
| Wimperntusche | China | 521 |
Dauerbrenner: Sonnenschutz
Damit Sonnenschutzprodukte den Verbraucher effektiv vor den hautschädigenden UV-Strahlen schützen können, kommt es sowohl auf die Zusammensetzung der Produkte als auch auf die richtige Anwendung der Mittel an. Darauf weist auch das BfR in seiner Stellungnahme hin. Die UV-Filter bedingen die Lichtschutzwirkung. Hierzu können verschiedene Substanzen verwendet werden, die vor ihrer Verwendung hinsichtlich ihrer Sicherheit bewertet und mit Höchstmengen zugelassen werden müssen. Bei 125 Produkten wurde die Zusammensetzung im Hinblick auf die enthaltenen Lichtschutzsubstanzen überprüft. Davon mussten zwei Erzeugnisse beanstandet werden, da die zulässigen Höchstmengen an organischen UV-Filtersubstanzen überschritten waren.
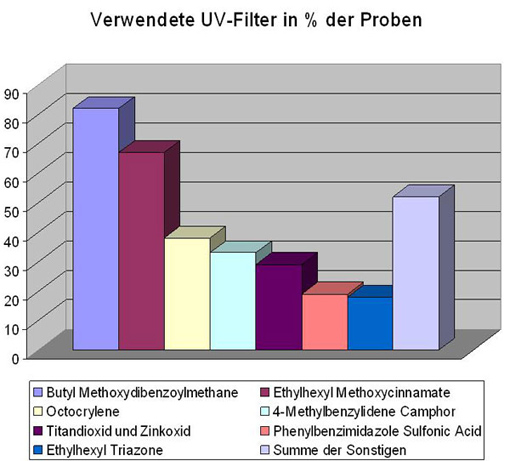
Von den nach der KosmetikV zugelassenen 28 Stoffen (26 organische UV-Filtersubstanzen und die Pigmente Titandioxid und Zinkoxid) wurden 17 organische Verbindungen und die beiden anorganischen Pigmente bei den untersuchten Formulierungen verwendet, wobei die Häufigkeit der einzelnen Verbindungen deutlich unterschiedlich war – wie das Diagramm „Verwendete UV-Filter in % der Proben“ zeigt. So enthielten 67 % der Erzeugnisse den im UVB-Bereich absorbierenden Filter „Ethylhexyl Methoxycinnamate“ und bei über 80 % wurde der UVA-Filter „Butyl Methoxydibenzoylmethane“ eingesetzt. Damit zählen diese beiden Filtersubstanzen immer noch zu den am häufigsten verwendeten Verbindungen.
In 33 % der Produkte war die zugelassene Filtersubstanz „4-Methylbenzylidene Camphor“ enthalten. Bei dieser Verbindung konnte der im Tierversuch aufgekommene Verdacht auf eine Beeinflussung von Schilddrüsenhormonen bislang nicht widerlegt werden. Das BfR hat in seiner Stellungnahme empfohlen, diese UV-Filtersubstanz vom Markt zu nehmen. Eine rechtliche Handhabe besteht jedoch nicht, solange diese Substanz nach der Positivliste zugelassen ist. Bei der Überprüfung der Marktsituation im Jahr 2006 wird darauf zu achten sein, inwieweit der Empfehlung des BfR nachgekommen wird.
Bei insgesamt 60 Produkten wurden Transmissionsmessungen als analytische Verfahren zur Bestimmung der UV-Schutzwirkung durchgeführt. Die Proben wurden hierzu in einer definierten Menge auf einen geeigneten Träger aufgebracht und die Transmission und damit die Absorption durch das Produkt im Wellenlängenbereich zwischen 290 und 400 nm bestimmt. Der „in-vitro-Lichtschutzfaktor“ errechnet sich aus den ermittelten Absorptionswerten der einzelnen Wellenlängen und einer Wichtung dieser Werte mit dem erythemalen Wirksamkeitsspektrum. Die Auswertung der ersten Mess-Serie zeigte eine überwiegend zufriedenstellende Übereinstimmung zwischen den gemessenen und den deklarierten Lichtschutzfaktoren.
Die Verbraucher von Sonnenschutzmitteln sollen möglichst umfassend vor den schädlichen Auswirkungen des Sonnenlichtes geschützt werden. Der UVA-Lichtanteil des Sonnenlichtes leistet einen nicht zu vernachlässigenden Beitrag zur Schädigung der Haut, weshalb die Höhe des UVA-Schutzes der Höhe des UVB-Schutzes angepasst sein sollte. Eine objektive, allgemein anerkannte in-vitro-Bestimmungsmethode zur Ermittlung des UVA-Schutzes wurde 2005 mit der DIN-Methode 67502 eingeführt. Die Bestimmung der UVA-Bilanz erfolgt gleichzeitig mit der Lichtschutzfaktorprüfung, wobei die ermittelten Absorptionswerte die Grundlage für die weiteren Rechenoperationen darstellen. Über die erforderliche Höhe der UVA-Bilanz wird aber derzeit in den Fachkreisen noch diskutiert.
Fluoridierte Mundwässer - sinnvolle Ergänzung zur Kariesprophylaxe?
Neben Zahnpasten werden auch vielfach Mundwässer zur Reinigung von Zähnen und Mundraum eingesetzt.
Derartige Produkte sorgen durch die enthaltenen Aromastoffe für einen frischen Atem und reduzieren durch antimikrobielle Wirkstoffe Bakterien, die zur Mundgeruchs- und Zahnbelagsbildung beitragen. Neuerdings enthalten Mundspülungen teilweise auch Fluoridzusätze zur Unterstützung der Kariesprophylaxe. Die zulässige gesamte Höchstmenge, die in Mundpflegemitteln eingesetzt werden darf, liegt bei 0,15 % Fluorid. Das BfR hat in einer Stellungnahme die zusätzliche Fluoridaufnahme durch Mundwässer wissenschaftlich bewertet: Da Fluoride aus mehreren Quellen (Lebensmittel, Trinkwasser, fluoridierte Speisesalze und Zahnpasten) aufgenommen werden, kann die zur Kariesprophylaxe optimale Fluoridaufnahme leicht überschritten werden. Chronisch nur wenig erhöhte Fluoridaufnahmen verursachen jedoch während der Entwicklungszeit der Zähne (bis zum 8. Lebensjahr) so genannte Dentalfluorosen (weißliche Flecken im Zahnschmelz). Die regelmäßige Anwendung hochdosierter fluoridhaltiger
Mundspüllösungen kann auch bei Erwachsenen eine Fluoridaufnahme bedingen, die zu unerwünschten Einlagerungen von Fluorid in die Knochen führen kann. Aufgrund dessen empfiehlt das BfR folgendes: „Die Fluoridkonzentrationen in Mundspüllösungen für Jugendliche und Erwachsene sollte maximal 0,05 % betragen. Mundspüllösungen für Kinder ab sechs Jahren sollten maximal zwei Mal täglich verwendet werden oder der Fluoridgehalt sollte auf 0,02 % beschränkt werden; Kinder unter sechs Jahren sollten keine fluoridhaltigen Mundwässer benutzen.“ Vor diesem Hintergrund wurden Mundwässer in einer stichprobenartigen Untersuchungsserie unter die Lupe genommen. Bei zwei Drittel der 37 vorgelegten Produkte handelte es sich um gebrauchsfertige Mundspülungen, die übrigen Produkte waren Konzentrate, die vor Gebrauch zu verdünnen sind. Während bei den untersuchten Mundwasser-Konzentraten nur eine Probe fluoridhaltig war (0,05 %), enthielten 83 % der vorgelegten, gebrauchsfertigen Mundspüllösungen Fluoridzusätze. Die ermittelten Fluoridkonzentrationen lagen alle im Bereich von 0,01 bis maximal 0,05 %. Alle Erzeugnisse entsprachen damit dem vom BfR empfohlenen maximalen Fluoridgehalt in Mundspülungen für Jugendliche und Erwachsene.
Die meisten Produkte trugen auch die vom BfR empfohlenen Hinweise. Bei drei Proben mit Fluoridgehalten zwischen 0,02 und 0,035 % fehlte jedoch der Hinweis, dass fluoridhaltige Mundspüllösungen für Kinder unter sechs Jahren nicht verwendet werden sollen. Bei einem weiteren Produkt mit 0,035 % Fluorid, das für Kinder ab fünf Jahren und nach jedem Zähneputze eingesetzt werden soll, wurde die für den Hersteller zuständige Behörde ersucht, die Sicherheitsbewertung des Herstellers zu diesem Mundpflegemittel hinsichtlich der Gefahr der Dentalfluorosen zu überprüfen.
Nicht auf den ersten Blick erkennbar – die mikrobiologische Beschaffenheit kosmetischer Mittel
In den seltensten Fällen ist ein mikrobieller Verderb mit bloßem Auge erkennbar. Da die Anwendung von Kosmetika, die beispielsweise mit krankmachenden Mikroorganismen kontaminiert sind, beim Verbraucher gesundheitliche Beeinträchtigungen nach sich ziehen kann, liegt eine der Aufgaben des Verbraucherschutzes in der Überprüfung des mikrobiologischen Zustands kosmetischer Mittel.
Bei 105 aus dem Handel oder bei Betriebskontrollen entnommenen Proben fand eine Überprüfung ihrer mikrobiologischen Beschaffenheit statt. 74 % der Produkte waren mikrobiologisch unauffällig. Bei vier kosmetischen Erzeugnissen wurde jedoch eine Verkeimung mit dem pathogenen Keim „Pseudomonas aeruginosa“ festgestellt. Diese Proben waren dadurch bei vorhersehbarem Gebrauch als geeignet zu betrachten, die Gesundheit zu schädigen. Weitere Erzeugnisse wurden aufgrund einer Verkeimung dahingehend beanstandet, dass die Grundsätze der Guten Herstellungspraxis keine Anwendung gefunden haben.
Ein besonderes Augenmerk wurde 2005 aufgrund der Beteiligung des Schwerpunktlabors Kosmetik an Verbraucherschutzaktionen bei der BUGA auf die Untersuchung von kosmetischen Produkten gelegt, die vor allem während und nach der Gartenarbeit verwendet werden, wie beispielsweise Handreinigungsund Handpflegemittel.
Zur Reinigung der stark verschmutzten Hände nach der Arbeit im Garten werden auch Spezialhandreinigungsmittel verwendet, die zur Beseitigung von grobem Schmutz so genannte „Abrasivstoffe“ enthalten. Es handelt sich dabei um granuläre Zusätze, die den Schmutz aufgrund mechanischer Abreibung lösen. Diese festen Putzkörper können beispielsweise aus feinkörnigem Sand oder aus Holz-, Kunststoff- oder Kreidemehlen bestehen. Von insgesamt 15 mikrobiologisch untersuchten Handwaschpasten waren sechs Produkte mit Keimen in unterschiedlichem Ausmaß belastet, wobei auffällig war, dass allein vier dieser Erzeugnisse einen Holzmehl-Zusatz aufwiesen.
Irreführung – Versprechen und Wirkung von Kosmetika?
Werbeaussagen bei kosmetischen Mitteln sind für den Verbraucher bei der Auswahl eines kosmetischen Mittels kaufentscheidend.
Die rechtlichen Vorgaben sind im LFGB und in der KosmetikV festgelegt. So ist es verboten, kosmetische Mittel unter irreführender Bezeichnung, Angabe oder Aufmachung gewerbsmäßig in den Verkehr zu bringen bzw. mit Wirkungen zu werben, die wissenschaftlich nicht hinreichend gesichert sind. Irreführend sind Aussagen, Aufmachungen und Darstellungen, die bei einer Auslegung nach Sprachgebrauch, Lebenserfahrung und Verkehrsauffassung geeignet sind, bei dem Abnehmerkreis eine falsche Vorstellung über die tatsächlichen Verhältnisse hervorzurufen. Nach dem Verbraucherleitbild des Europäischen Gerichtshofes wird der Durchschnittsverbraucher als informiert, aufmerksam und verständig gesehen.
Auf dieser Basis ist uns eine neue Vorgehensweise aufgefallen, die wir „Sternchenstrategie“ nennen.
Zum Beispiel wird eine Langzeitwirkung in der Tiefe der Haut versprochen, die auf dem Zusatz eines patentierten Komplexes beruht. Die Aussage wird mit einem Sternchen gekennzeichnet. In der Fußnote findet sich der Hinweis, dass die Wirksamkeit des Komplexes durch einen „in-vitro-Test“ nachgewiesen worden ist, also im Reagenzglas oder auf künstlicher Haut. Werbeaussagen zum Fertigerzeugnis, die sich auf die Wirkung auf der Haut beziehen, werden so nur durch Nachweise eines Stoffgemisches auf Hautmodellen belegt. Es wird nicht das Produkt geprüft, sondern nur ein Bestandteil. Die ermittelten Ergebnisse eines Bestandteiles im Reagenzglas werden aber mit der Wirkung des Fertigproduktes gleichgestellt und auf die menschliche Haut übertragen. In der Literatur heißt es jedoch hierzu, dass eine direkte Übertragung auf die menschliche Haut von in-vitro-ablaufenden Reaktionen oder von Resultaten, die an biologischen Modellen oder im Tierversuch ermittelt worden sind, nicht möglich ist.
Eine weitere Strategie wird über so genannte „Anwendertests“ verfolgt. Eine Auslobung wie „Geglättete Falten: 75 %“ wird werbemäßig stark hervorgehoben. Nur durch ein Sternchen wird der Verbraucher auf die Fußnote aufmerksam gemacht, die sich zumeist quer und sehr klein geschrieben am Rand des Werbetextes befindet. Die Fußnote informiert, dass diese Aussage nicht bedeutet, dass 75 % der Falten geglättet worden sind, sondern dass 75 % der Testpersonen nach einem Anwendertest die abgefragte Wirkung „Faltenglättung“ positiv beantwortet haben. Diese durch Selbsteinschätzung erzielten Ergebnisse sind nach unserer Auffassung subjektiv; sie können keine objektiv messbaren und wissenschaftlich fundierten Ergebnisse ersetzen. Da in beiden Fällen der Verbraucher über die Tatsachen informiert wird und er aufgrund der Rechtsprechung als aufmerksam und verständig zu betrachten ist, gestaltet sich der schlüssige Nachweis einer Irreführung schwierig, auch wenn davon auszugehen ist, dass durch die Art der Darstellung die ausgelobten Wirkungen automatisch auf das Fertigerzeugnis übertragen werden.
BSE-Zertifikate für den Export von Kosmetika
Seit 2004 können kosmetische Mittel von Deutschland in die Volksrepublik China nur exportiert werden, wenn den chinesischen Behörden Zertifikate vorgelegt werden, die bestätigen, dass die Produkte weder BSE-Risikomaterialien noch bestimmte Rohstoffe tierischen Ursprungs enthalten. Die beiden zuständigen chinesischen Behörden
– die Verbraucherschutz-/ Quarantänebehörde und das Gesundheitsministerium – verlangen verschiedene Zertifikate, die sich sowohl in der Form als auch im Inhalt (Vorgaben bzgl. unzulässiger Rohstoffe bzw. Tierarten) deutlich unterscheiden. Als zuständige Zertifizierungsstelle wurde für Bayern das LGL benannt. Die Sachverständigen des LGL überprüfen anhand der Produktunterlagen der Hersteller, insbesondere der Spezifikationen der eingesetzten Rohstoffe, ob keine unzulässigen Rohstoffe verwendet werden, die aus Rind, Schaf oder Ziege gewonnen wurden. Die Anzahl der von acht bayerischen Firmen beantragten Zertifikate ist im Vergleich zum Vorjahr drastisch angestiegen: 930 im Jahr 2005 (Vorjahr: 208).
![]()
Überprüfung der Produktunterlagen
Wie schon in den vergangenen Jahren wurde auch im Berichtszeitraum routinemäßig und aufgrund aktueller Anlässe bei verschiedenen bayerischen Kosmetikherstellern Einsicht in die Produktunterlagen genommen. Nach wie vor zeigen sich vor Ort große Unterschiede in der Qualität der Unterlagen; die Skala reicht von nahezu vollständig mit hoher Aussagekraft bis zu völlig unzureichend.
Aufgrund des Erlöschens fiktiver Arzneimittelzulassungen im Zeitraum 2001-2003 endete die Verkehrsfähigkeit vieler Arzneimittel. Dennoch wird bei einigen dieser Präparate, die äußerlich anzuwenden sind, der Versuch unternommen, diese als kosmetische Mittel in den Verkehr zu bringen. Bei einem Hersteller, der ein derartiges Erzeugnis als Körperpflegemittel in den Verkehr brachte, musste festgestellt werden, dass die vorhandenen Unterlagen für die kosmetischen Anforderungen nicht ausreichend waren.
Mehrere Beanstandungen, sowohl vom LGL als auch von Behörden anderer Bundesländer, wegen der Überschreitung von Höchstmengen von UV-Filtern bei Sonnenschutzmitteln erforderten die Überprüfung der Produktunterlagen beim Hersteller. Es wurden weitgehend vollständige Unterlagen vorgelegt. Als Grund für die Höchstmengenüberschreitung kam möglicherweise ein technischer Defekt bei der automatischen Zudosierung des flüssigen UV-Filters in Frage. Bis zur endgültigen Klärung der Ursache erfolgt die Zuführung dieses Rohstoffes nach manueller Einwaage zum Herstellungsprozess.
Allergene Duftstoffe in Kosmetika sind jetzt deklarationspflichtig
In der Bestandteilliste von Kosmetikprodukten, die nach dem 10.03.2005 erstmalig in Verkehr gebracht wurden, müssen eingesetzte Duftstoffe angegeben werden, wenn sie zu den 26 in der KosmetikV genannten, potentiell Allergie auslösenden Substanzen gehören und ihre jeweilige Konzentration bestimmte Grenzwerte überschreitet (bei kosmetischen Mitteln, die ausgespült werden: Konzentrationen über 0,01 %; bei sonstigen Produkten: Konzentrationen über 0,001 %). Diese Kennzeichnungsverpflichtung wurde eingeführt, um betroffene Allergiker zu informieren; dieser Personenkreis kann dadurch für sich geeignete Produkte erkennen und ungeeignete meiden. Vor diesem Hintergrund wurden in einem Schwerpunktprojekt 91 Körperpflegeprodukte auf 8 dieser deklarationspflichtigen Duftstoffe (Benzylbenzoat, Benzylsalicylat, Butylphenyl Methylpropional, Cinnamal, Citral, Geraniol, Limonen, Linalool) untersucht. Bei den Proben handelte es sich überwiegend um Körperlotionen auf Emulsionsbasis sowie um Kinderpflegelotionen und Gesichts- bzw. Handpflegeprodukte. Unter den geprüften Produkten waren auch stärker parfümierte Produkte aus Pflegeserien von Parfummarken.
Art, Häufigkeit und Menge der nachgewiesenen Duftstoffe:
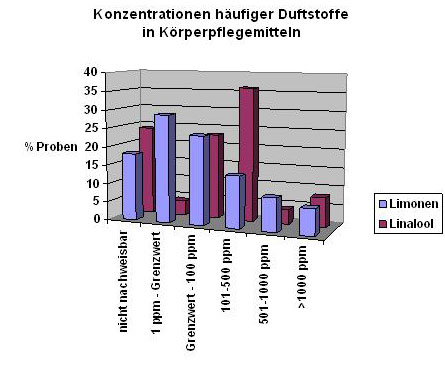
Die Duftstoffe Linalool und Limonen wurden von den 8 geprüften Substanzen am häufigsten, d.h. in 71 bzw. 54 % der Proben, in deklarationspflichtiger Menge nachgewiesen. In einem Drittel der Proben waren die Substanzen Butylphenyl Methylpropional und Benzylsalicylate in Konzentrationen über 0,001 % enthalten. Cinnamal dagegen spielte praktisch keine Rolle (nur in 1 Probe in relevanter Menge enthalten). Die Konzentrationen, in denen die beiden am häufigsten nachgewiesenen Duftstoffe Linalool und Limonen vorlagen, sind in der Grafik „Konzentrationen häufiger Duftstoffe in Körperpflegemitteln“ dargestellt. Während diese beiden Haupt-Duftstoffkomponenten häufig in Konzentrationen über 0,01 % (100 ppm) auftraten, war dies bei den anderen untersuchten Duftstoffen eher selten der Fall.
Deklaration:
In 31 % der untersuchten Lotionen und Cremes war bereits eine Duftstoff-Deklaration vorhanden. In weiteren 16 % der vorgelegten Produkte waren keine deklarationspflichtigen Duftstoffe aufgelistet und es konnte auch keiner der geprüften 8 Duftstoffe nachgewiesen werden.
In mehr als der Hälfte der geprüften Lotionen wurden deklarationspflichtige Duftstoffe nachgewiesen, die im Verzeichnis der Bestandteile des Produkts nicht angegeben waren. Wegen der bestehenden Übergangsfrist dürfen jedoch all diejenigen Produkte, die vor dem 11.03.2005 erstmalig in Verkehr gebracht wurden, auch ohne Duftstoffdeklaration weiterhin zeitlich unbegrenzt verkauft werden. Wegen der häufig sehr langen Mindesthaltbarkeitsdauer von kosmetischen Mitteln (über 2,5 Jahre) werden daher auch in den kommenden Jahren noch Produkte ohne Duftstoffdeklaration rechtmäßig im Handel sein.