- Startseite >>
- Produkte >>
- Kosmetika >>
- Kosmetische Mittel
Hautbleichmittel – ein Risiko?
Abstract
Hautbleichende kosmetische Mittel schwächen nicht nur altersbedingte Pigmentflecken ab, sondern können auch die Haut im Ganzen aufhellen. Allerdings kann die Verwendung von derartigen Produkten unter Umständen auch mit gesundheitlichen Risiken einhergehen, wenn sie verbotene oder gesundheitlich bedenkliche Stoffe enthalten.
Am LGL wurden diese Produkte auf verbotene bzw. gesundheitlich bedenkliche Wirkstoffe wie Hydrochinon, Kojisäure, Quecksilber und Clobetasolpropionat untersucht. Des Weiteren wurde die Kennzeichnung dieser Produkte überprüft.
Einleitung
Hautbleichmittel sind kosmetische Mittel, die nicht nur Pigmentflecken oder Sommersprossen abschwächen sollen, sondern auch die Haut im Ganzen aufhellen können, (Abb. 1). Mit der Verwendung von derartigen Produkten können, insbesondere bei großflächiger und /oder lang andauernder Anwendung, gesundheitliche Risiken einhergehen. Oftmals stammen die Hautbleichmittel aus Ländern, die nicht dem europäischen Kosmetikrecht unterliegen. Daher ist die Beanstandungsquote dieser Produkte nach den Vorgaben der Verordnung (EG) Nr. 1223/2009 (EU-Kosmetikverordnung) stets sehr hoch.
Abbildung 1: Unterschiedlich stark pigmentierte Haut an zwei Armen (links); Oberarm mit Sommersprossen, mit einem Bereich schwach pigmentierter Haut (rechts).
Untersuchung
Im Zeitraum von 2021 bis 2022 wurden am LGL 35 Proben im Hinblick auf das Vorkommen von bleichenden bzw. gesundheitlich bedenklichen Inhaltsstoffe untersucht. Zudem wurde die Einhaltung der rechtlichen Vorgaben bezüglich der Kennzeichnung der Produkte überprüft. Von den 35 Proben waren nur 6 Proben ohne Beanstandung (Abb. 2). Für die restlichen 29 Proben (83%) wurden Beanstandungen ausgesprochen. Bei 17 Proben (59%) lagen ausschließlich Verstöße gegen Kennzeichnungsvorschriften vor. Weitere 12 Proben (41%) wurden als „nicht sicher“ beurteilt. Bei den letztgenannten Proben wurde auf eine zusätzliche Beurteilung der Kennzeichnung verzichtet.
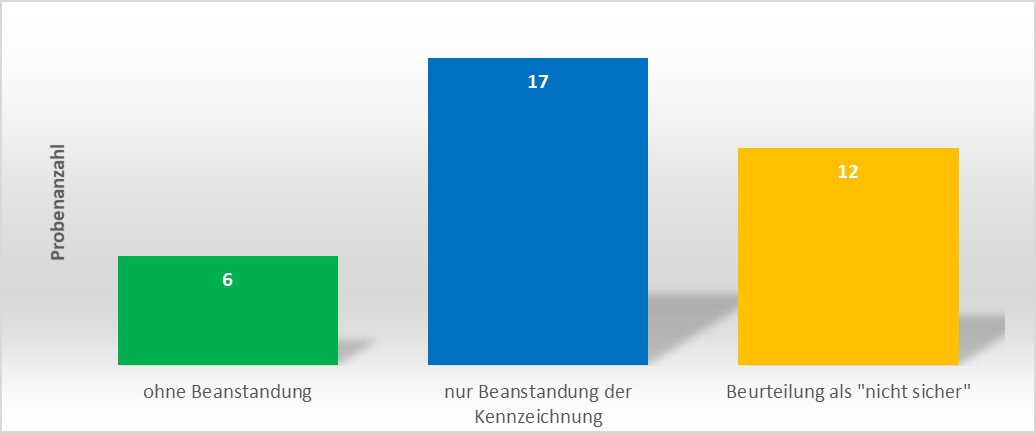
Abbildung 2: Übersicht zu untersuchten Hautbleichmittelproben.
Hautbleichende Wirkstoffe
Hydrochinon und Kojisäure stellen besonders häufig eingesetzte hautbleichende Wirkstoffe dar. Darüber hinaus werden auch Quecksilber und Clobetasolpropionat (Glucocorticoid) immer wieder in Hautbleichmitteln nachgewiesen.
Hydrochinon
Die bleichende Wirkung von Hydrochinon erfolgt durch die kompetitive Hemmung des Enzyms Tyrosinase, was zu einer Verringerung der Bildung neuer Pigmente führt (2). Neben der angestrebten Depigmentierung können bei Anwendung höherer Konzentrationen an Hydrochinon (>3%) auch unerwünschte Wirkungen wie Hautirritationen, Erytheme und Dermatosen oder sogar eine Hautsensibilisierung auftreten (2). Aufgrund seiner Einstufung als genotoxisches Kanzerogen wurde die Verwendung in kosmetischen Mitteln nach der EU-Kosmetikverordnung auf künstliche Fingernagelsysteme beschränkt. Die Verbindung ist demnach in Mitteln, die auf der Haut verbleiben, wie z.B. Körperlotionen, verboten.
Kojisäure
Die bleichende Wirkung der Kojisäure erfolgt, wie bei Hydrochinon, über die Hemmung der Tyrosinase. Bei Kojisäure handelt es sich um ein Mykotoxin, das u.a. von verschiedenen Stämmen der Pilzgattung Aspergillus gebildet wird. Im menschlichen Körper kann Kojisäure die Iodaufnahme in der Schilddrüse beeinträchtigen (3).
Aktuell ist der Einsatz von Kojisäure in der EU-Kosmetikverordnung nicht explizit geregelt. Allerdings hat der wissenschaftliche Ausschuss der EU (Scientific Committee on Consumer Safety, SCCS) in seiner Bewertung aus dem Jahr 2012 eine Konzentration von 1% als Höchstmenge für eine sichere Verwendung angesehen (4).
Im Corrigendum zu dieser Bewertung vom Oktober 2021 wurde als Konzentration für eine noch sichere Verwendung sogar nur noch ein entsprechender Gehalt von 0,04% für die kombinierte Verwendung als Gesichts- und Handcreme berechnet (5).
In der vom SCCS im Juni 2022 veröffentlichten Final Opinion on Kojic acid wurde der als sicher bewertete Gehalt wieder auf 1% angehoben (3). Daher ergeben sich für die Proben, in Abhängigkeit zum jeweiligen Zeitpunkt der Probenahme, abweichende Beurteilungsgrundlagen.
Quecksilberverbindungen
Die Verwendung von Quecksilberverbindungen wie z.B. Quecksilberchlorid wird im Zusammenhang mit der Entwicklung des nephrotischen Syndroms (Nierenschädigung) genannt (6). Der Einsatz von Quecksilberverbindungen ist in kosmetischen Mitteln nach der EU-Kosmetikverordnung verboten. Bei knapp einem Viertel der Proben im angegebenen Untersuchungszeitraum erfolgte auch eine Untersuchung auf Quecksilberverbindungen, die in den Proben jeweils nicht bestimmbar waren.
Clobetasolpropinat
Clobetasolpropinat wird der Gruppe der Glucocorticoide zugeordnet. Als Wirkstoff in Arzneimitteln wird es zur Behandlung von verschiedenen Hauterkrankungen, insbesondere von Psoriasis und Ekzemen, eingesetzt (7). Die topische Anwendung von Clobetasolpropionat steht u.a im Zusammenhang mit dem Auftreten von Steroid-Akne und von Dehnungsstreifen (Striae) (1).
Der Einsatz von Glucocorticoiden ist in kosmetischen Mitteln nach der EU- Kosmetikverordnung verboten.
Das LGL wies teilweise sehr hohe Gehalte der in Hautbleichmitteln verbotenen Stoffe Hydrochinon und Clobetasolpropionat nach (Tab. 1) und beanstandete diese Proben entsprechend. Die quantifizierte Menge an Kojisäure lag in drei Proben innerhalb des Probenahmezeitraums von Oktober 2021 bis Juni 2022 jeweils über der damals vom SCCS für eine sichere Anwendung als Gesichts- und Handcreme berechnete Konzentration von 0,04% (Tab. 1) (5).
In fünf Proben, die von Januar 2021 bis Oktober 2021 sowie im 2 Halbjahr 2022 gezogen wurden, lag der Gehalt an Kojisäure im Bereich von 0,15 – 0,86% und somit unter dem vom SCCS zu dieser Zeit für sicher bewerteten Höchstwert von 1% (4,6). Deshalb waren diese Proben aufgrund der Gehalte an Kojisäure nicht zu beanstanden. Zwei Proben überschritten den geltenden Höchstwert für Kojisäure von 1% und wurden entsprechend beanstandet.
| Analyt | Anzahl der Proben mit quantifizierbarer Menge | Gehalt | Einstufung |
|---|---|---|---|
| Hydrochinon | 9 | 0,042 – 5,262% | Nach EU-KosmetikVO in Hautbleichmitteln verboten |
| Clobetasol-propionat | 3 | 0,013% – 0,038% | |
| Quecksilber | 0 | ||
| Kojisäure | 3 | 0,099 – 1,04% | In EU-KosmetikVO nicht geregelt; 0,04% vom SCCS als sicher bewertete Menge, Oktober 2021 bis Juni 2022 (5) |
| Kojisäure | 7 | 0,15 – 3,020% | In EU-KosmetikVO nicht geregelt; 1% vom SCCS als sicher bewertete Menge; 2012 bis Oktober 2021 (4) Anhebung auf 1% als sicher bewertete Menge in finaler SCCS Opinion, ab Juni 2022 (3) |
Sichere Verwendung
Das Vorhandensein von verbotenen oder gesundheitlich bedenklichen Stoffen in hohen Mengen führt teilweise auch über die Beurteilung als „nicht sicheres“ kosmetisches Mittel nach Art. 3 der EU-Kosmetikverordnung hinaus. Von den 12 Proben, die als nicht sicher beurteilt wurden, wurden 9 Proben sogar als „ernste Gefahr“ gemäß Durchführungsbeschluss (EU) 2019/417 (Rapex-Leitlinie) eingestuft.
Neben den enthaltenen Inhaltsstoffen darf nicht vernachlässigt werden, dass auch die Dauer der Anwendung als kritisch zu betrachten ist. Denn nur selten werden Hautbleichmittel kleinflächig angewendet, vielmehr verleiteten Aufmachung und explizite Werbung zu einer Ganzkörperanwendung über viele Wochen und Monate.
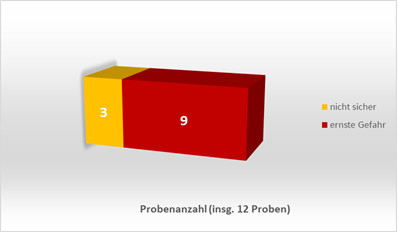
Abbildung 3: Einstufung von 9 der 12 „nicht sicheren“ Proben als ernste Gefahr nach der Rapex-Leitlinie.
Kennzeichnung
Gemäß Art. 19 der EU-Kosmetikverordnung werden konkrete Vorgaben an die Kennzeichnung von kosmetischen Mitteln gestellt, die eingehalten werden müssen. Verstöße, die im Rahmen der hier vorgestellten Untersuchungen häufig festgestellt wurden (Abb. 4), betrafen hierbei:
- die Vorgaben zur verpflichtenden Kennzeichnung in deutscher Sprache (i.V.m. § 4 nationale Kosmetikverordnung)
- korrekte Angabe einer für das Produkt verantwortlichen Person innerhalb der EU
- nicht ausreichende Anwendungshinweise/Warnhinweise zur korrekten Anwendung des Produkts
- nicht korrekte Nennung und Bezeichnung der eingesetzten Inhaltsstoffe
- Deklaration verbotener Inhaltsstoffe in der Liste der Bestandteile
 Abbildung
4: Beispiele für fehlerhafte Angaben in der Etikettierung nach EU-Kosmetikverordnung.
Abbildung
4: Beispiele für fehlerhafte Angaben in der Etikettierung nach EU-Kosmetikverordnung.
Fazit
Diese Ergebnisse machen deutlich, dass Hautbleichmittel eine sehr kritische Produktkategorie darstellen. Daher wird das LGL auch in Zukunft zum Schutz der Verbraucher die Untersuchung von Hautbleichmitteln auf verbotene bzw. gesundheitlich bedenkliche Stoffen fortführen. Die vom LGL erstellten Gutachten wurden und werden auch künftig zur Ergreifung der nach Sach- und Rechtslage gebotenen Maßnahmen an die betroffenen Überwachungsbehörden weitergeleitet.
Maßnahmen
Hydrochinon, Quecksilber und Clobetasolpropionat sind bereits nach der EU-Kosmetikverordnung verboten. Für Kojisäure fehlt hingegen bisher eine Höchstmengen-Regelung in der EU-Kosmetikverordnung. Vom SCCS wurde in der im Juni 2022 veröffentlichten Final Opinion on Kojic acid ein Kojisäure-Gehalt von 1% als sicher bewertet. Es ist geplant, dass Kojisäure mit dem vom SCCS als sicher bewerteten Höchstwert in die EU-Kosmetikverordnung aufgenommen werden soll.
Literatur
- Naidoo, L., Khoza, N., Dlova, N.C. (2016). A Fairer Face, a Fairer Tomorrow? A Review of Skin Lighteners. Cosmetics, 3(3) 33.
- DFG: Gesundheitsschädliche Arbeitsstoffe: Toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten – 1,4-Dihydroxybenzol. Wiley VCH Verlag, 20. Lfg., 1994
- Scientific Committee on Consumer Safety (SCCS, 2022): OPINION on Kojic Acid – Final version & Corrigendum. SCCS/1637/21.
- Scientific Committee on Consumer Safety (SCCS, 2012): OPINION on Kojic Acid. SCCS/1481/12.
- Scientific Committee on Consumer Safety (SCCS, 2021): OPINION on Kojic Acid - Corrigendum. SCCS/1637/21.
- Clarkson, T. W. (1989). Mercury. Journal of the American College of Toxicology, 8(7), 1291–1295.
- TGA (2013): Australian Public Assessment Report for Clobetasol propionate, Ltd PM- 2011-01596-3-5


