- Startseite >>
- Lebensmittel >>
- Chemie >>
- Schimmelpilzgifte >>
- Ochratoxine
Ochratoxine
Ochratoxine werden wie Aflatoxine von typischen Lagerpilzen gebildet. Ochratoxine sind weltweit anzutreffen und treten in einer Vielzahl pflanzlicher und tierischer Lebensmittel auf [1]. Sie können nach einem Pilzbefall hauptsächlich in verschiedenen Getreidearten wie Reis, Gerste, Hafer und Weizen, aber auch in vielen Obst- und Gemüsearten (z. B. Trauben, Feigen) gebildet werden. Auch Verarbeitungserzeugnisse wie Wein, Obst-/Gemüsesäfte und Bier können Ochratoxine enthalten. Daneben werden Ochratoxine in Fruchtgewürzarten (z. B. Senf, Pfeffer, Paprika), Kaffee, Kakao und deren Verarbeitungserzeugnissen (Schokolade) gefunden. Außerdem wurde über das Vorkommen von Ochratoxinen in Nüssen (Pistazien, Kastanien), Tee, pflanzlichen Nahrungsergänzungsmitteln und tierischen Produkten (z. B. Leber, Niere, Schinken) berichtet. [2]
Ochratoxin A
Das bedeutendste und am weitesten verbreitete Ochratoxin ist Ochratoxin A (OTA) [2]. 1965 wurde es erstmals aus Kulturen des Schimmelpilzes Aspergillus ochraceus isoliert, nach dem es auch benannt ist [3]. Aber auch andere Aspergillus- und verschiedene Penicillium-Arten können Ochratoxin A bilden [2]. Da die Penicillien und Aspergillen neben Ochratoxin A noch eine Reihe anderer Toxine bilden können, kommt Ochratoxin A häufig zusammen mit sogenannten Begleittoxinen vor, wie z. B. Citrinin und Penicillinsäure [1].
Ochratoxin A wirkt nieren- und leberschädigend und wird wegen seiner krebserzeugenden Wirkung bei Versuchstieren als eine für den Menschen möglicherweise krebserzeugende Substanz eingestuft [3].
Daneben gibt es weitere strukturähnliche Ochratoxine wie z. B. Ochratoxin B (Dechloro-Ochratoxin A) und Ochratoxin C (Ethylester-Ochratoxin A), welche viel seltener oder gar nicht und in weitaus geringeren Mengen als Ochratoxin A in Lebensmitteln vorkommen [2].
Chemie und Bildung von Ochratoxin A
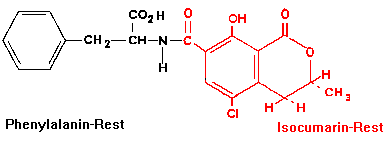
Abbildung 1: Chemischer Aufbau von Ochratoxin A
Die Ochratoxine sind Verwandte der Isocumarinderivate, die mit L-Phenylalanin peptidartig verbunden sind [2].
Der Schimmelbefall und damit die potenzielle Bildung von Ochratoxin A wird durch ungünstige Temperatur- und Feuchtigkeitsbedingungen bei Ernte, Trocknung, Verarbeitung, Transport und Lagerung begünstigt und ist durch geeignete Verarbeitungs-, Transport- und Lagertechnologie weitgehend vermeidbar [1].
Wie die meisten Mykotoxine bleibt Ochratoxin A beim Erhitzen größtenteils erhalten. So wurde bei einer Erhitzung auf 150 °C für 1 Stunde nur eine Abnahme von 30 % festgestellt. Allerdings kann bei einer Erhitzung auf 180 °C, wie beim Rösten von Kaffee, eine Reduzierung um 70 % erreicht werden [2]. Dennoch spielt die vorherige Vermeidung von Schimmelbefall zur Reduktion der Toxinbelastung im Lebensmittel die entscheidende Rolle, da eine Dekontamination des verzehrfertigen Lebensmittels ohne Beeinträchtigung seiner charakteristischen Eigenschaften (u. a. Geruch, Geschmack, Textur) nicht möglich ist [1].
Gesundheitliche Beurteilung von Ochratoxin A
Ochratoxin A wird als krebserzeugend und erbgutschädigend eingestuft. Außerdem ist es ein Nervengift, wirkt fruchtschädigend und greift das Immunsystem an. Das Hauptzielorgan ist die Niere [2].
Die Internationale Agentur für Krebsforschung (International Agency for the Research in Cancer, IARC) stufte Ochratoxin A als möglicherweise krebserzeugend für den Menschen ein. Für mindestens eine Tierart (Mäuse und Ratten) erwies es sich als Ursache für die Entstehung von Krebs [3].
Die Tatsache, dass Ochratoxin A in Blutplasma, Blut und Urin nachgewiesen wird und sogar in Muttermilch vorkommen kann, legt eine kontinuierliche Ochratoxin A-Belastung des Verbrauchers durch pflanzliche und tierische Nahrung nahe. Die European Food Safety Authority (EFSA) berichtete im Jahr 2020, dass die Belastung in Europa mit der Belastung der letzten Bewertung im Jahr 2006 vergleichbar wäre. Dennoch sei in Muttermilch die Konzentration in den letzten Jahren konsequent niedriger im Vergleich zu älteren Studien [2].
In der Risikobewertung der European Food Safety Authority (EFSA) schreibt das Gremium für Kontaminanten in der Lebensmittelkette (CONTAM Panel), dass die erbgutverändernden Wirkmechanismen von Ochratoxin A noch nicht im Detail geklärt sind. Deswegen wird zur Risikoabschätzung der margin of exposure (MOE) Ansatz verwendet. Hierbei wird das Verhältnis zwischen der kleinsten Dosis, bei der negative Auswirkungen gemessen wurden, und der geschätzten Exposition der Bevölkerung mit Ochratoxin A ermittelt [2].
Bei der Ermittlung der kleinsten Dosis mit negativen Auswirkungen wurde unterschieden zwischen Effekten, die das Tumorwachstum betreffen, und anderen negativen Auswirkungen wie z. B. Läsionen. Bezüglich der Tumorwachstum betreffenden Effekte wird ab einem MOE von > 10.000 davon ausgegangen, dass nur geringe gesundheitliche Bedenken bestehen, hinsichtlich anderer negativer Auswirkungen bestehen nur geringe gesundheitliche Bedenken ab einem MOE von 200. Der MOE von 10.000 ist zwar sehr hoch angesetzt, dies ist jedoch bedingt durch die ungeklärten Wirkmechanismen [2].
Die Bewertung der EFSA ergab, dass der MOE von 10.000 in fast allen Konsumentengruppen unterschritten wurde. Dies deutet auf mögliche gesundheitliche Bedenken hin. Allerdings könnte das Risiko aufgrund des hoch angesetzten MOE-Wertes auch überschätzt werden. Im Fall des MOE von 200 für andere negative Auswirkungen wurde der Wert nur in der Gruppe junger Vielverzehrer von Ochratoxin A-Risikoprodukten unterschritten. Dadurch wird hier von geringen Sicherheitsbedenken ausgegangen [2].
Jedoch muss besonders im Hinblick auf das neben dem Körpergewicht andere Ernährungsverhalten von Kindern und Kleinkindern eine weitere Minimierung der Belastung angestrebt werden. Zudem spricht sich das CONTAM Panel dafür aus, dass zusätzliche Studien und Informationen benötigt werden, um das Risiko noch besser einschätzen zu können [2].
Ochratoxin A in Lebensmitteln und Futtergetreide
Pflanzliche Lebensmittel und Futtergetreide
Unter den pflanzlichen Lebensmitteln nimmt ein durchschnittlicher Verbraucher am meisten Ochratoxin A durch den Verzehr von Getreide und Getreideprodukten auf. Außerdem tragen getrocknete und frische Früchte wie Weintrauben, Feigen und Datteln, sowie Fruchtsäfte und Nektare vor allem bei Kleinkindern zur Exposition von Ochratoxin A bei. Eine weitere wichtige Expositionsquelle stellen Süßholzwurzelprodukte wie Lakritz dar [2].
Aufgrund ihres Belastungspotentials werden am Bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit (LGL) regelmäßig Getreideprodukte wie Mehle, getrocknete Früchte (z. B. Feigen, Rosinen), Gewürze, Nüsse und Verarbeitungserzeugnisse (Säfte, Wein, Bier, Kaffee, Kakao, Schokolade) auf Ochratoxin A untersucht (
 .
.
Abbildung 2: Diverse Lebensmittel, die am LGL auf verschiedene Mykotoxine untersucht werden
In den letzten Jahren wurden unter anderem getrocknete Feigen, Rosinen, Paprikapulver und Roggenmehl mit einer Höchstgehaltsüberschreitung an Ochratoxin A vom LGL beanstandet. Der Großteil der auf Ochratoxin A untersuchten Proben muss jedoch erfreulicherweise nicht beanstandet werden.
Lebensmittel tierischer Herkunft
Fleisch und Fleischprodukte (z. B. Schinken, geräucherter Schinken und Würste) sowie Käse sind laut EFSA (2020) zusammen mit Getreideprodukten die drei Hauptkategorien, die zu einer Ochratoxin A Belastung beitragen. Jedoch schwanken die Ochratoxin A-Gehalte bei diesen tierischen Produkten stärker, wohingegen Getreideprodukte eine relativ konstante Belastung aufweisen [2].
Bei Lebensmitteln tierischer Herkunft kann eine Kontamination mit Mykotoxinen auch durch einen sogenannten „carry over“-Effekt stattfinden. Wenn Nutztiere Schimmelpilzgifte über belastete Futtermittel aufnehmen, können diese in verschiedenen Organen, hauptsächlich Leber und Niere, angereichert oder – auch in metabolisierter Form – über die Milch ausgeschieden werden [1].
Ochratoxin A wird schnell im Körper absorbiert und verteilt, aber nur langsam wieder ausgeschieden. Da Ochratoxin A an Plasmaproteine binden kann und nur langsam metabolisiert wird, kann eine Anreicherung im Körper stattfinden. In verschiedenen Spezies kann die biologische Halbwertszeit von Ochratoxin A im Blutplasma stark variieren. Bei Nagetieren und Schweinen beträgt sie mehrere Tage, bei Primaten und Menschen hingegen mehrere Wochen. In Kuhmilch und Milch von anderen Wiederkäuern ist die Ochratoxin A Belastung eher gering, da die Substanz im Pansen zu Ochratoxin alpha abgebaut wird. Ochratoxin alpha wird im Gegensatz zu Ochratoxin A nicht in der Niere angereichert, sondern schnell über den Urin wieder ausgeschieden [2].
Neben diesem - durch „carry over“ bedingten - Eintrag wird in der Literatur aber auch bei verzehrsfertigen Lebensmitteln tierischer Herkunft, wie Rohwurst oder Käse, über eine Sekundärkontamination durch Schimmel während der Verarbeitung, Lagerung und Reifung und einen dadurch bedingten Eintrag von Ochratoxin A berichtet [2].
Im Rahmen des Nationalen Rückstandskontrollplans werden alljährlich vom Mykotoxinlabor des LGL Lebern und Nieren von Schweinen und Fischen auf Ochratoxin A untersucht.
Höchstmengenregelung für Ochratoxin A
EU-weit sind Höchstmengen an Ochratoxin A für verschiedenste Lebensmittel (z. B. Getreideerzeugnisse, getrocknete Weintrauben, Wein, Kaffee, Gewürze) im Bereich zwischen 0,5 bis 80 µg/kg in der Verordnung (EG) Nr. 1881/2006 festgelegt [4]. Zusätzlich sind in der nationalen Kontaminantenverordnung Höchstgehalte für getrocknete Feigen und weiteres Trockenobst, das nicht in der Verordnung (EG) Nr. 1881/2006 geregelt ist, vorgeschrieben [5]. Für Einzelheiten zur Höchstmengenregelung siehe: Höchstmengenregelungen für Mykotoxine in Lebensmitteln in der Europäischen Union (EU) und in Deutschland.
Quellen und weiterführende Hinweise
[1] Lebensmittel-Mykologie, Martin Weidenbörner, 1. Aufl., Hamburg: Behr, 1998
[2] EFSA Panel on Contaminants in the Food Chain, Scientific Opinion, Risk assessment of ochratoxin A in food, EFSA Journal 2020, 18 (5), 6113, Parma, Italy
[3] IARC (International agency for research on cancer) IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans: Some naturally occurring substances: Food items and constituents, heterocyclic aromatic amines and mycotoxins. 1993 Vol 56, pp. 397–444. Lyon, France
[4] Verordnung (EG) Nr. 1881/2006 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln (ABl. L 364 S. 5), zuletzt geändert durch Art. 1 VO (EU) 2020/1322 vom 23.9.2020 (ABl. L 310 S. 2)
[5] Verordnung zur Begrenzung von Kontaminanten in Lebensmitteln (Kontaminanten-Verordnung - KmV), vom 19. März 2010 (BGBl. I S. 286), zuletzt geändert durch Art. 1 Zweite ÄndVO vom 1.7.2020 (BGBl. I S. 1540)
Mehr zu diesem Thema
Allgemeine Informationen zum Thema
Untersuchungsergebnisse
- Untersuchungsschwerpunkt 2021: Aflatoxine und Ochratoxin A in Pseudogetreide
- Ochratoxin A in getrockneten Weintrauben – Untersuchungsergebnisse 2019
- Schokoladen-Weihnachtsmänner auf dem Prüfstand: Untersuchungen zur Belastungssituation mit dem Schimmelpilzgift Ochratoxin A 2017
- Ochratoxin A und Aflatoxine in Tee und teeähnlichen Erzeugnissen – Untersuchungsergebnisse 2017
- Ochratoxin A in Getreide – Untersuchungsergebnisse 2016
Archiv
- Ochratoxin A und Tropanalkaloide in Buchweizenmehl und –körnern – Untersuchungsergebnisse 2015
- Ochratoxin A in teilweise vergorenen Traubenmosten (Sauser) – Untersuchungsergebnisse 2013
- Ochratoxin A (OTA) in Süßholzwurzel, teeähnlichen Erzeugnissen und Traubensäften - Untersuchungsergebnisse
- Aflatoxine B/G und Ochratoxin A in Gewürzen und Würzmischungen – Untersuchungsergebnisse 2005
- Ochratoxin A-Belastung in Wein, Traubensaft und -most sowie Weinessig – Untersuchungsergebnisse 2004

