Belastung der bayerischen Bevölkerung mit Acrylamid
Allgemeine Informationen
Acrylamid (AA) entsteht während der so genannten Maillard-Reaktion beim Erhitzen von stärkehaltigen Lebensmitteln, insbesondere beim Backen, Braten, Rösten, Grillen und Frittieren. Die Aminosäure Asparagin, die vor allem in Kartoffeln und in Getreide vorkommt, wird unter Erhitzen in Acrylamid umgewandelt, zusätzlich unterstützt wird die Acrylamidbildung durch Kohlenhydrate wie Fructose und Glucose.
Daher entsteht besonders viel Acrylamid, wenn kartoffel- und getreidehaltige Lebensmittel trocken über 180°C erhitzt werden. Die Acrylamidbildung beginnt bereits bei 120°C, steigt jedoch bei 170 - 180°C deutlich an. Daher enthalten Lebensmittel wie Knäckebrot, Pommes Frites, Kartoffelchips, aber auch Kaffee, teilweise hohe Mengen an Acrylamid.
Das Bundesinstitut für Risikobewertung gibt eine tägliche Aufnahme über die Nahrung von 0,5 - 1 µg/kg Körpergewicht und Tag an (= 30-60 µg tägliche Zufuhr).
Eine weitere wichtige Quelle an Acrylamid stellt Tabakrauch dar. Für Zigarettenraucher liegen Daten vor, die eindeutig zeigen, dass der Gehalt an entsprechenden Stoffwechselprodukten mit zunehmendem Zigarettenkonsum steigt.
Acrylamid besitzt ein reaktives Potential gegenüber biologischen Makromolekülen wie Proteinen und Desoxyribonukleinsäure (kurz DNS oder DNA), der Trägerin der Erbinformation. Stoffe wie Acrylamid, die mit der DNS chemische Reaktionen eingehen, werden als gentoxisch bezeichnet und sind damit häufig auch krebserzeugend. So führt Acrylamid im Tierversuch zur Bildung verschiedener Tumortypen in unterschiedlichen Organen.
Daneben zeigt Acrylamid in Tierexperimenten an verschiedenen Spezies nach wiederholter oraler Gabe (20-50 mg/kg Körpergewicht) neurotoxische Wirkungen, die sich als Ataxien (Störungen des Bewegungsablaufes), Gliedmaßenschwäche, verminderte motorische Aktivität, Krämpfe sowie Sehstörungen manifestieren. Diese Neurotoxizität wird auch in Fallbeispielen beobachtet, bei denen Personen am Arbeitsplatz gegenüber Acrylamid exponiert waren (mehr Details siehe Link auf der rechten Seite).
Human-Biomonitoring
Das Binden des reaktiven Acrylamids an den Globinrest des Hämoglobins ermöglicht es, die interne Belastung des Menschen zu erfassen. Eine der Bindungsstellen des Globins ist die freie Aminogruppe der Aminosäure Valin. Das Acrylamid-Valin ist eine Art Langzeitbiomarker, da die Blutzellen, die das Hämoglobin enthalten (rote Blutkörperchen oder Erythrozyten), eine durchschnittliche Lebensdauer von 120 Tagen aufweisen. Da während dieser Zeit immer wieder Reaktionen zwischen Valin und Acrylamid eintreten können, wird so die mittlere Belastung über circa 120 Tage ermittelt.
Da der Organismus regelmäßig auf reaktive Stoffe trifft, hat sich ein effizientes Entgiftungssystem im Organismus entwickelt. Ein den Proteinen ähnliches Tripeptid, das Glutathion, ist ein Baustein dieses Schutzsystems. Mit Hilfe spezieller Enzyme, den Glutathion-S-Transferasen, führt die Reaktion von Glutathion mit reaktiven Stoffen zu unreaktiven und damit meist untoxischen Abbauprodukten. Diese Abbauprodukte werden über die Nieren mit dem Harn ausgeschieden. Durch die Messung solcher Metabolite im Harn des Menschen können ebenfalls wichtige Informationen über die Belastungssituation des Menschen gegenüber Fremdstoffen wie Acrylamid erhalten werden.
Untersuchungsergebnisse im Urin
Ergebnisse aus drei überwiegend in Bayern durchgeführten Studien bestätigen, dass die tägliche Aufnahme an Acrylamid einige Mikrogramm bis zu einem Milligramm betragen kann (Tabelle 1). Die Medianwerte für Nichtraucher liegen zwischen 27 und 72 µg täglicher Aufnahme und damit im Bereich der durchschnittlichen Aufnahme, der vom Bundesinstitut für Risikobewertung mittels der Gehalte an Acrylamid in Lebensmitteln abgeschätzt wurde. Hohe Werte findet man wie bereits erwähnt bei Rauchern und bei Personen, die überwiegend Acrylamid-haltige Nahrungsmittel verzehrt haben. Als Beispiel sei hier ein Experiment mit Lebkuchen genannt, die laut Herstellerangaben einen Gehalt von 735 µg/kg aufwiesen. Drei freiwillige Personen verzehrten jeweils drei dieser Lebkuchen (167 g). Für den Hauptmetaboliten, das N-Acetyl-S-(2-carbamoylethyl)cystein, wurden Höchstwerte von bis zu 1000 µg/l im Urin circa sechs bis acht Stunden nach Verzehr der Lebkuchen erreicht [1]. Diese Konzentrationen entsprechen in etwa denen, die von starken Rauchern erreicht werden können.
| Anzahl Probanden | Bereich [µg/l] | Median [µg/l] | Tägliche Aufnahme (Median) [µg]b |
Literatur |
|---|---|---|---|---|
| Nichtraucher | ||||
| 13 | 14-102 | 26 | 65 | [1] |
| 16 | 3-83 | 29 | 72 | [5] |
| 60 | 28-306a | 42 | 105 | [6] |
| 47 | 7-47a | 16a | 27 | [7] |
| Gelegentliche Raucher | ||||
| 12 | 16-630 | 56 | 140 | [1] |
| Ständige Raucher | ||||
| 13 | 61-706 | 283 | 709 | [1] |
| 13 | 17-338 | 127 | 318 | [5] |
| 60 | 25-539a | 107 | 268 | [6] |
| 6 | 38-106a | 74a | 124 | [7] |
a µg in 24 h;
b Die Werte in µg/l müssen mit den Faktor 1,5 (tägliches Urinvolumen ~ 1,5 l) multipliziert werden, um die tägliche Ausscheidung an Acrylamidmetaboliten wiederzugeben. Zusätzlich wird angenommen, dass es sich dabei um eine Gleichgewichtskonzentration handelt, d. h. eine ständige Aufnahme und Ausscheidung von Acrylamid im Gleichgewicht. Da nur ca. 60% der Dosis an Acrylamid über den Urin ausgeschieden werden, sind die 24-h-Werte nochmals mit dem Faktor 1,67 zu multiplizieren.
Die Bestimmung der Metabolite im Urin kann auch dazu genutzt werden zu ermitteln, mit welcher Geschwindigkeit und in welcher Menge aufgenommenes Acrylamid ausgeschieden wird. Die effiziente Ausscheidung eines Fremdstoffes verringert dessen Potential, unerwünschte Wirkung im Körper auszulösen. Aus verschiedenen Studien mit freiwilligen Probanden wurden diese so genannten kinetischen Daten ermittelt. Es zeigte sich, dass Acrylamid nach circa 72 Stunden zu etwa 60 % ausgeschieden worden ist [2]. Für den oben genannten Hauptmetaboliten wurde eine Halbwertszeit (die Zeit, nach der die Hälfte der ursprünglichen Dosis ausgeschieden wurde) von circa 17 Stunden ermittelt. Eine exakte Ermittlung der Kennzahlen ist aber schwierig, da man über die Nahrung permanent weiteres Acrylamid aufnimmt.
Untersuchungsergebnisse im Blut
Das Reaktionsprodukt des Acrylamids mit dem endständigen Valin des Globins (N-(2-Carbamoylethyl)valin: AAVal) wurde 1997 erstmals in Blutproben von nicht beruflich gegenüber Acrylamid exponierten Menschen nachgewiesen [3]. Mittlerweile sind zahlreiche Analysen durchgeführt worden. Insbesondere ein bayerisches Kollektiv von über tausend Personen wurde im Rahmen einer bayernweiten Studie untersucht.
Belastung und Beanspruchung der bayerischen Bevölkerung mit Acrylamid und aromatischen Aminen
Abbildung 1 zeigt die Gehalte an N-(2-Carbamoylethyl)valin-Addukten von Rauchern und Nichtrauchern im Vergleich.
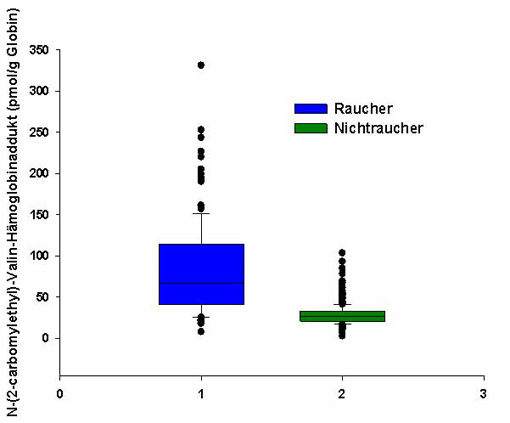
Abbildung 1: Acrylamid-Proteinaddukte bei 1008 bayerischen Probanden spezifiziert nach Rauchern und Nichtrauchern (modifiziert nach [8, 4])
Bei Nichtrauchern wurden Adduktspiegel zwischen 3 und 103 pg Proteinaddukt/pmol Globin bestimmt, der Median lag bei 27 pg/pmol und das 95. Perzentil bei 49 pg/pmol. Die Raucher wiesen dagegen Werte zwischen 8 und 331 pg/pmol, einen circa 2,5fach höheren Median und ein 4fach höheres 95. Perzentil im Vergleich zu den Nichtrauchern auf.
Die Kommission Human-Biomonitoring des Umweltbundesamtes hat in einer Stellungnahme die Daten verschiedener Studien zusammengefasst (siehe rechte Spalte "Links").
Muttermilchuntersuchungen
Muttermilchuntersuchungen liefern wichtige Hinweise auf die Exposition des Menschen gegenüber Fremdstoffen.
Zur Acrylamid-Belastung der Muttermilch wurde am LGL eine der weltweit größten Untersuchungen durchgeführt.
Die Gehalte lagen zu circa 95% unterhalb von 0,3 µg/kg Milch, das heißt bei einer Aufnahme von etwa einem Liter Muttermilch nimmt der Säugling maximal 300 ng Acrylamid auf. Damit bewegte sich die durchschnittliche Aufnahme (etwa 100 ng/l Milch, 5 kg schwerer Säugling) mit 0,02 µg/kg Körpergewicht und Tag deutlich unter der von Erwachsenen oder Kindern im Schulalter.
Ausblick
Ob sich die vielfach angeregten und beschriebenen Maßnahmen zur Reduzierung des Acrylamidgehaltes in Nahrungsmitteln beziehungsweise die bewusste Auswahl an Lebensmitteln mit geringen Acrylamidkonzentrationen durch den Verbraucher tatsächlich in geringeren Expositionsmengen niederschlagen, werden zukünftige Biomonitoringstudien zu den Urin- und Blutmetaboliten zeigen.
Literatur
1. Kellert, M., Scholz, K., Wagner, S., Dekant, W., and Volkel, W.: Quantitation of mercapturic acids from acrylamide and glycidamide in human urine using a column switching tool with two trap columns and electrospray tandem mass spectrometry. J Chromatogr A, 2006. 1131(1-2): p. 58-66.
2. Fuhr, U., Boettcher, M. I., Kinzig-Schippers, M., Weyer, A., Jetter, A., Lazar, A., Taubert, D., Tomalik-Scharte, D., Pournara, P., Jakob, V., Harlfinger, S., Klaassen, T., Berkessel, A., Angerer, J., Sorgel, F., and Schomig, E.: Toxicokinetics of acrylamide in humans after ingestion of a defined dose in a test meal to improve risk assessment for acrylamide carcinogenicity. Cancer Epidemiol Biomarkers Prev, 2006. 15(2): p. 266-71.
3. Bergmark, E.: Hemoglobin adducts of acrylamide and acrylonitrile in laboratory workers, smokers and nonsmokers. Chem Res Toxicol, 1997. 10(1): p. 78-84.
4. Kutting, B., W. Uter, and H. Drexler: The association between self-reported acrylamide intake and hemoglobin adducts as biomarkers of exposure. Cancer Causes Control, 2007.
5. Boettcher, M.I., Schettgen, T., Kutting, B., Pischetsrieder, M., and Angerer, J.: Mercapturic acids of acrylamide and glycidamide as biomarkers of the internal exposure to acrylamide in the general population. Mutat Res, 2005. 580(1-2): p. 167-76.
6. Urban, M., Kavvadias, D., Riedel, K., Scherer, G., and Tricker, A. R.: Urinary mercapturic acids and a hemoglobin adduct for the dosimetry of acrylamide exposure in smokers and nonsmokers. Inhal Toxicol, 2006. 18(10): p. 831-9.
7. Bjellaas, T., Stolen, L. H., Haugen, M., Paulsen, J. E., Alexander, J., Lundanes, E., and Becher, G.: Urinary acrylamide metabolites as biomarkers for short-term dietary exposure to acrylamide. Food Chem Toxicol, 2007. 45(6): p. 1020-6.
8. Kütting, B., Schettgen, T., Schwegler, U., Fromme, H., Uter, W., Angerer, J., Drexler, H.: Acrylamide as environmental noxious agent - a health risk assessment for the general population based on the internal acrylamide burden. Int J Hyg Environ Health, 2009. 212(5): p. 470-480.

